ದ್ವಿತೀಯ ಪಿಯುಸಿ: ರುದರ್ ಫೋರ್ಡ್ನ ಸಿದ್ಧಾಂತಗಳ ವೈಫಲ್ಯಗಳು
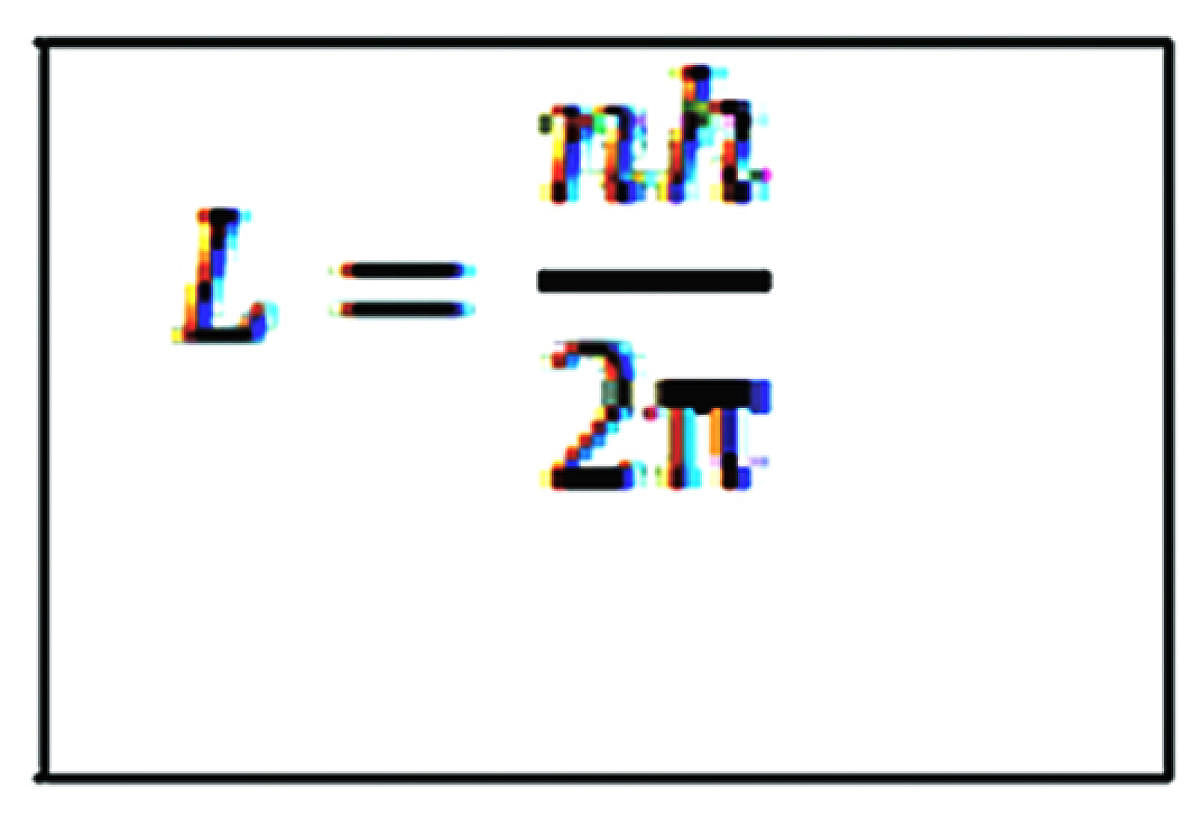
ಭೌತಶಾಸ್ತ್ರ
ಸಾಂಪ್ರದಾಯಿಕ ವಿದ್ಯುತ್ಕಾಂತೀಯ ಸಿದ್ಧಾಂತದ ಪ್ರಕಾರ ವೇಗೋತ್ಕರ್ಷ ಹೊಂದುತ್ತಿರುವ ವಿದ್ಯುದಾವಿಷ್ಟ ಕಣವು ವಿಕಿರಣಗಳನ್ನು ವಿದ್ಯುತ್ಕಾಂತೀಯ ಅಲೆಗಳ ರೂಪದಲ್ಲಿ ಹೊರಸೂಸುತ್ತದೆ. ಆದ ಕಾರಣ ವೇಗೋತ್ಕರ್ಷ ಹೊಂದುತ್ತಿರುವ ಎಲೆಕ್ಟ್ರಾನ್ನ ಶಕ್ತಿಯು ಸತತವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತಾ ಹೋಗುತ್ತದೆ. ಕೊನೆಗೆ ಎಲೆಕ್ಟ್ರಾನ್ ಸುರುಳಿಯಾಕಾರದಲ್ಲಿ ಸುತ್ತುತ್ತಾ ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿ ಬಂದು ಬೀಳಬೇಕಾಗುತ್ತದೆ. ಅಂತಹ ಪರಮಾಣುಗಳು ಸ್ಥಿರವಾಗಿರುವುದಿಲ್ಲ.
ಅಲ್ಲದೆ ತಿರುಗುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿಂದ ಹೊರಸೂಸಲ್ಪಟ್ಟ ವಿದ್ಯುತ್ಕಾಂತೀಯ ತರಂಗಗಳ ಆವೃತ್ತಿಯು ಅದರ ಪರಿಭ್ರಮಣದ ಆವೃತ್ತಿಗೆ ಸಮನಾಗಿರಬೇಕು. ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಒಳಮುಖವಾಗಿ ಸುರುಳಿಯಾಕಾರದಲ್ಲಿ ಸುತ್ತುವುದರಿಂದ ಆವೃತ್ತಿ ಸತತವಾಗಿ ಬದಲಾಗಿ ರೇಖಾ ರೋಹಿತಕ್ಕೆ ವಿರುದ್ಧವಾದ ಅವಿಚ್ಛಿನ್ನ (ನಿರಂತರ) ರೋಹಿತವನ್ನು ಹೊರಸೂಸಬೇಕಾಗುತ್ತದೆ.
ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನ ಬೋರ್ ಮಾದರಿ
1. ಬೋರ್ರವರ ಮೊದಲ ಸ್ವಯಂ ಸಿದ್ಧ: ಯಾವುದೇ ಪರಮಾಣುವಿನಲ್ಲಿರುವ ಯಾವುದೇ ಎಲೆಕ್ಟ್ರಾನ್ ಸ್ಥಿರ ಕಕ್ಷೆಯಲ್ಲಿರುವಾಗ ವಿಕಿರಣವನ್ನು ಹೊರಸೂಸದೆ ಪರಿಭ್ರಮಿಸಬಲ್ಲದು ಮತ್ತು ಅಸ್ತಿತ್ವದಲ್ಲಿರುವ ಪ್ರತಿ ಪರಮಾಣುವಿಗೆ ಕೆಲವು ನಿರ್ದಿಷ್ಟ, ನಿಶ್ಚಿತ, ಸ್ಥಿರ, ಸ್ಥಿತಿಗಳಿದ್ದು, ಪ್ರತಿ ಸಂಭಾವ್ಯ ಸ್ಥಿತಿಗಳಲ್ಲಿ ಅವುಗಳಿಗೆ ಖಚಿತವಾದ ಒಟ್ಟು ಶಕ್ತಿ ಇರುತ್ತದೆ. ಇವುಗಳನ್ನು ಸ್ಥಿರ ಸ್ಥಿತಿಗಳೆಂದು ಕರೆಯುತ್ತಾರೆ.
2. ಬೋರ್ರವರ ಎರಡನೇ ಸ್ವಯಂ ಸಿದ್ಧ: ನ್ಯೂಕ್ಲಿಯಸ್ ಸುತ್ತ ಎಲೆಕ್ಟ್ರಾನ್ನ ಕೋನೀಯ ಸಂವೇಗವು h/2π ಪೂರ್ಣಾಂಕ ಅಪವರ್ತ್ಯಗಳಿರುವ ಕಕ್ಷೆಗಳಲ್ಲಿ ಮಾತ್ರ ಪರಿಭ್ರಮಿಸುತ್ತವೆ. ಇಲ್ಲಿ h ಪ್ಲಾಂಕ್ ಸಿದ್ಧಾಂತ ಸ್ಥಿರಾಂಕ (6.626× 10-34 JS) ಪರಿಭ್ರಮಿಸುವ ಎಲೆಕ್ಟ್ರಾನ್ನ ಕೋನೀಯ ಸಂವೇಗವು ಕ್ವಾಂಟೀಕರಣಗೊಂಡಿದೆ.
ಅಂದರೆ
3. ಬೋರ್ರವರ ಮೂರನೇ ಸ್ವಯಂ ಸಿದ್ಧ: ಯಾವುದೇ ಎಲೆಕ್ಟ್ರಾನ್ನ ನಿರ್ದಿಷ್ಟ ಅವಿಕಿರಣಶೀಲ ಕಕ್ಷೆಯಿಂದ ಬೇರೆ ಕಡಿಮೆ ಶಕ್ತಿಯ ಕಕ್ಷೆಯೆಡೆಗೆ ಸಂಕ್ರಮಣ ಹೊಂದಬಲ್ಲದು. ಈ ರೀತಿ ಆದಾಗ ಫೋಟಾನ್ ಒಂದು ಚಿಮ್ಮಲ್ಪಟ್ಟು ಅದರ ಶಕ್ತಿಯು ಪ್ರಾರಂಭ ಹಾಗೂ ಕೊನೆಯ ಸ್ಥಿತಿಗಳ ನಡುವಿನ ಶಕ್ತಿ ವ್ಯತ್ಯಾಸಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ.
hv=Ei-Ef ಇಲ್ಲಿ Ei ಮತ್ತು Ef ಗಳು ಆರಂಭಿಕ ಹಾಗೂ ಕೊನೆಯ ಸ್ಥಿತಿಗಳ ಶಕ್ತಿ.
ಎಲೆಕ್ಟ್ರಾನ್ನ ಸ್ಥಿರ ಕಕ್ಷೆಯ ತ್ರಿಜ್ಯ
m ಮೊತ್ತದ ರಾಶಿ ಮತ್ತು -e ಆವೇಶ ಹೊಂದಿರುವ ಎಲೆಕ್ಟ್ರಾನ್ + Ze ಆವೇಶ ಹೊಂದಿರುವ ನ್ಯೂಕ್ಲಿಯಸ್ ಡಿ ತ್ರಿಜ್ಯದಲ್ಲಿ v ಜವದೊಂದಿಗೆ ಪರಿಭ್ರಮಿಸುತ್ತಿದೆ ಎಂದು ತಿಳಿಯೋಣ.
ಸ್ಥಾಯೀ ವಿದ್ಯುದಾವೇಶ ಆಕರ್ಷಣ ಬಲ
ಕೇಂದ್ರಾಭಿಮುಖ ಬಲ
ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಸ್ಥಾಯೀ ವಿದ್ಯುದಾವೇಶ ಬಲ (fe)ದಿಂದ ಕೇಂದ್ರಾಭಿಮುಖ ಬಲ (fc)ವನ್ನು ಪಡೆಯುವುದರಿಂದ ಸ್ಥಿರ ಕಕ್ಷೆಯಾಗಿ fe= fc ಇರಬೇಕಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ ಬೋರ್ನ ನಿಯಮದ ಪ್ರಕಾರ n ಕಕ್ಷೆಯ ಕೋನೀಯ ಸಂವೇಗ ಸಮೀಕರಣ (1)ರಲ್ಲಿ v ಬೆಲೆಯನ್ನು ಹಾಕಿದಾಗ ಮೇಲಿನ ಸಮೀಕರಣದ ಪ್ರಕಾರ ತ್ರಿಜ್ಯವು ಸ್ವಾಭಾವಿಕ ಸಂಖ್ಯೆಗಳ ವರ್ಗಕ್ಕೆ ನೇರ ಅನುಪಾತವಾಗಿದೆ. ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನಲ್ಲಿ z=1 ಮತ್ತು n=1 ನಂತರ ಬೋರ್ನ ತ್ರಿಜ್ಯ
ತಾಜಾ ಸುದ್ದಿಗಾಗಿ ಪ್ರಜಾವಾಣಿ ಟೆಲಿಗ್ರಾಂ ಚಾನೆಲ್ ಸೇರಿಕೊಳ್ಳಿ | ಪ್ರಜಾವಾಣಿ ಆ್ಯಪ್ ಇಲ್ಲಿದೆ: ಆಂಡ್ರಾಯ್ಡ್ | ಐಒಎಸ್ | ನಮ್ಮ ಫೇಸ್ಬುಕ್ ಪುಟ ಫಾಲೋ ಮಾಡಿ.

